南极的环境极其寒冷、多风和干燥。臭氧消耗导致了紫外线b辐射的增加,温室气体的增加和平流层臭氧的减少改变了南极洲的气候。苔藓是如何在这样恶劣的环境下进行光合作用的?南极苔藓利用了小气候的优势,在那里,风的保护、充足的融水、海鸟的营养和最佳的阳光为有效的新陈代谢提供了光合能量和足够的热量。阳光的数量提出了一个挑战:更多的光线会产生更温暖的冠层,这对光合酶来说是最理想的,但可能包含过多的光能,可能会损坏光化学装置。因此,南极苔藓以叶黄素循环色素的形式表现出很强的光保护潜力。在条件最极端的情况下,特别是在含水量较低的情况下,玉米黄质的转化率很高。南极苔藓也产生紫外线屏蔽化合物,这些化合物维持在某些物种的细胞壁中,似乎可以保护DNA免受紫外线- b辐射升高的损害。因此,这些植物在地球上最恶劣的地方之一生存下来,利用最好的环境来优化它们的新陈代谢。但是生存是不稳定的,随着南极气候的变化,这些策略是否仍然有效还有待观察。
南极洲寒冷、干燥、多风。它的陆生植物以苔藓植物(苔藓和苔类植物)和地衣为主。这些植物遍布整个大陆的沿海无冰区,甚至内陆的努纳塔克(图1)。在海洋/半岛地区,也有两种被子植物:一种垫子植物Colobanthus quitensis和南极毛草Deschampsia antarctica (Cannone et al. 2016, 2022;Loisel et al. 2017;Torres-Mellado et al. 2011)。
图1

南极地图(a)和南设得兰群岛(b-j, p)和风车群岛地区(k-o)沿溪流生长的一些苔藓的照片;麦ellansyntrichia (b) chisodontium aciphyllum (c) Sanionia georgicouncinata (d) Syntrichia filaris (e) Warnstorfia sarmentosa (f)和Bryum pseudotriquetrum (g) Livingston Island岸边的苔藓草皮(h)和detail (i)。Schistidium rivulare在岩石上以小button的形式生长(j)在南极特别保护区(ASPA) 135 (k)的一条冰冻溪流旁(l)被雪覆盖(m)或漂浮在液化水中(l)(n)由于光合作用产生的气泡被包围在周围的冰中而被从草皮上移走(o)有明显新鲜生长的几十年树龄的假三角角藻垫的横截面(p)地图原始来源:南极研究科学委员会经许可修改。摄影Alicia Perera, Sharon Robinson, Jessica Bramley-Alves和Krystal Randall)
南极洲东部一些最广泛的苔藓床是在澳大利亚南极凯西站附近的风车群岛地区发现的(66.2821°S, 110.5285°E;图1a, k-o)。这些广阔的苔藓床靠近空间站,使生理学研究得以进行数十年,自20世纪80年代以来发表了超过35篇论文(包括Lewis Smith 1999;Melick et al. 1994;Melick and Seppelt 1994;Roser et al. 1992;特恩布尔和罗宾逊2009;Ashcroft et al. 2017;Nydahl et al. 2015;Bramley-Alves等,2014a, b;Lucieer et al. 2014;Bramley - Alves et al. 2015;Hennion et al. 2006;Wasley et al. 2012;Robinson et al. 2000,参见下文引用的额外论文)使我们更好地了解这些植物如何在这种极端环境中生存和茁壮成长。
像任何植物一样,苔藓需要水、阳光和养分来进行光合作用和生长。在这里,我们概述了这些南极苔藓是如何与环境相互作用的,以及我们对它们如何在如此恶劣的条件下进行光合作用的理解。光在很多方面对南极苔藓都至关重要——不仅仅是作为光合作用的能量。红外线(IR)波长提供融化冰所需的热量和光化学反应所需的液态水(见冰雪中的水)。光合有效辐射(PAR)为光合作用提供能量,但红外能量也将苔藓床加热到光合作用最有效的温度(见最佳温度和小气候部分)。当PAR能量超过光合作用所需的量时,必须安全地消散以避免损害(见保护部分),而伴随的紫外线辐射既可以发出一系列细胞过程的信号(保护),也可以造成损害(紫外线辐射部分)。为了产生驱动光合作用的蛋白质和固定阳光的叶绿素,苔藓需要主要来自南极洲海洋资源的营养物质(肥料部分)。最后,我们还讨论了南极环境如何应对气候变化和臭氧消耗,以及这对其独特的苔藓植物群在未来可能意味着什么(未来部分)。
在这片寒冷的沙漠中,水是一个关键的限制因素(Davey and Rothery 1997;传达等人,2018;Robinson et al . 2003;Colesie et al 2022)。在东南极洲,水可以来自雪(沉淀或吹)和融水流。为了应对极端的环境,苔藓植物和地衣,以及生活在其中的无脊椎动物,必须能够承受频繁的干燥和补水循环,以及冻结和解冻。由于它们的双水性质,苔藓一年可以忍受长达9个月的干燥和雪下冻结,然后在短暂的夏季冰融化和淡水可用时设法生长。在冬季,积雪可以缓冲它们免受最恶劣的冬季温度的影响,沿海地区低于- 40°C,内陆地区更冷。虽然它们在雪下,苔藓也保护免受风的破坏。凡是能获得水源的地方都能找到苔藓。一些苔藓生长在融湖的边缘或周围,但大多数是由短暂的溪流喂养的,在整个夏天,融水流动的地方会出现郁郁葱葱的草皮(图1k)。
温度是南极洲植物生长的一个特别强大的驱动力,因为它决定了自由水的可用性,并直接影响新陈代谢(图2a)。虽然像凯西这样的沿海地区全年最高气温可超过0°C,但它们在12月和1月最常见;仅有的几个月平均最高气温高于0°C(图2a)。
图2
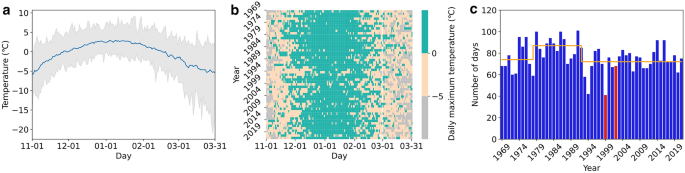
由英国气象局(BOM)于1969年至2022年在南极凯西站收集的气温资料,在此总结11月1日至3月31日的气温资料。(a)日温度范围以灰色阴影表示,平均温度以蓝线表示。一旦春天雪开始融化,免费的水就可以用来维持植物的生长。(b)日最高气温,其中绿色像素表示春夏生长季节日最高气温(上午9点后24小时)高于0°C、积雪可能融化、苔藓完全暴露的天数。在最高日温度在0至-5°C之间时,一些苔藓代谢可能在晴天发生(米色像素)。灰色像素表示气温保持在零下5摄氏度以下,苔藓可能处于休眠状态的日子。(c)生长季节最高温度超过0°c的天数。红色列表示文中提到的两个季节(1999-2000年和2002-2003年)。橙色线表示1979年和1993年确定的变化点前后的平均值。(注:BOM于1989年从Casey隧道位置迁至现址,参见Robinson et al. 2018)
当春天雪开始融化时,免费的水变得可用。一旦气温超过0°C(图2a, b),积雪很可能已经融化,苔藓将完全暴露。当气温在0到-5°C之间时,一些新陈代谢可能会在晴天发生,要么是雪下,要么是雪已经融化,苔藓暴露在外(Melick和Seppelt, 1992)。这种情况在春末和夏季更有可能发生,而在秋季,一旦雪岸融化退缩,苔藓干涸,这种情况就不太可能发生。一旦气温降至-5°C以下,苔藓可能会被冻结、干燥和休眠(Cannone et al 2017)。
根据这种融水的可用性,夏季生长季节因此非常短,自1969年以来,Casey每个季节的融水在40到100天之间(图2c)。自1993年以来,融化日数有所下降,20世纪80年代夏季平均潜在融化日数为87天,而2000年以来为72天。从该地区收集的苔藓核中也可以明显看出,夏季气温较低、风速增加和融化减少的影响显示出干燥趋势的证据(Robinson et al. 2018)。现代碳定年及碳(δ13)稳定同位素变化研究Clarke et al. 2012)从完整的苔藓芽中发现,风车群岛在截至2012年的50年里出现了干燥趋势(Robinson et al. 2018)。这与由于风速增加而导致的温度下降和干燥相对应,这些因素与下文所述的臭氧消耗的气候影响有关。
水可以以降水的形式直接沉积在植被上(图1m),但主要是从附近的冰川和较小的雪岸中排出,这些雪岸在春季融化(图1h, n;图3 c)。短暂的溪流提供不可靠的水,最好的苔藓床发现,在多个溪流确保整个夏天稳定的供水(图1;k, n,图3c)。
图3

从古代企鹅聚居地获得丰富营养的地方支持着广泛的苔藓床。风车岛卫星图像显示了大量苔藓床的位置(绿色椭圆)(a)。贝利半岛ASPA135的照片显示了一个山脊(前景),上面覆盖着3000-8000年前筑巢的企鹅沉积的adsamlie喙大小的鹅卵石(b)。在这些古老巢穴下面的洼地,苔藓茂盛地生长,来自附近雪堆的融水,如(c)所示,在雪堆下面的苔藓,绿色而健康,但在雪线之上。只有地衣和干苔藓被发现(灰色或红色的苔藓分别表示垂死和非常紧张的苔藓)。(图片Sharon Robinson, AAD地图95/056 https://data.aad.gov.au/aadc/mapcat/display_map.cfm?map_id=10)
全球苔藓植物的生长速率与光合作用吸收碳和呼吸作用损失碳这两个过程的平衡有关。因此,碳收支可以通过最佳的白天光合作用和夜间抑制呼吸来最大化。由于高温可以提高光合作用和呼吸速率,特别是在水分充足的条件下(Wilson 1990),因此必须将白天对温度的响应评估为光饱和净CO2同化,同时考虑到碳动力学的两个组成部分。一些南极苔藓在冠层温度高于20°C时呈现出最大的电子传递率(ETR)和日净CO2同化值(Perera-Castro et al. 2020及其参考文献),据报道,Bryum pseudotriquetrum和Ceratodon purpureus的极端值为25-30°C。在某些物种中,如南极血吸虫(Schistidium antarctici),在最佳温度为0至30°C的情况下,研究结果之间存在很大差异(Kappen et al. 1989;Davey and Rothery 1997;Block等人,2009;威尔逊1990;Perera-Castro et al. 2020)。关于温度关系的一个重要点是迄今为止大多数研究所描述的基础广泛的曲线,在广泛的温度范围内,包括在某些情况下0°C,净同化低但正(Longton 1988)。
对全球苔藓光合作用最适温度的修正也显示出普遍较高的最适温度,几乎没有纬度变化的证据(Perera-Castro et al. 2022a)。这些结果似乎与非南极苔藓在受控条件下生长的相对生长率的测量结果不同,非自然的光周期为12小时,白天和黑夜之间没有热振荡。据报道,在这种条件下,生长的平均最佳温度为19°C,长期温度为30°C对所有研究的苔藓都是致命的(Furness and Grime 1982a, b)。然而,当苔藓生长在更自然的温度制度下,夜间温度低于白天温度时,报告的相对生长率明显更高(Perera-Castro等人,2022a)。这表明,通过缩短夜间长度或暴露于低夜间温度来抑制夜间呼吸对苔藓的正碳平衡至关重要。这在南极洲尤其重要,在那里,苔藓目前只有3%的生长季节温度高于15°C (Perera-Castro et al. 2020)。因此,经常被描述为天生比被子植物更能适应寒冷条件的苔藓(Glime 2007)可能更多地与在低温下抑制呼吸的能力有关,而不是具有更低的光合作用最佳温度。出现了一个问题,即苔藓植物是否具有普遍较高的Q10呼吸值(每10°C温度变化的反应速率变化),或者Q10是否可以适应南极环境,正如高山维管植物所显示的那样(Larigauderie和K?rner 1995)。
这意味着,为了模拟不同气候变化情景对南极苔藓长期二氧化碳净吸收及其生存的影响,需要更好地了解呼吸作用对气温上升的反应。尽管还必须考虑在较暖的夜间呼吸速率增加对碳收支的长期影响,但在短暂的模拟热浪下,南极世界性的银Bryum的光饱和净CO2同化会增加(Gemal等人,2022)。
南极苔藓显示出在微观尺度上显著改变南极气候的特征,有利于它们的生存和生产力。此外,光合作用最适温度与苔藓草皮内产生的小气候条件非常相似(Longton 1988;Lewis Smith 1999;Perera-Castro et al. 2020;兰德尔2022)。这表明,苔藓草皮内的小气候条件为极端南极气候提供了缓冲,因此,在生物学和生态学上具有极高的相关性(Melick and Seppelt 1997, Convey et al. 2014;王2017;Robinson et al. 2018)。
温度、光和水都是南极苔藓的高低限制因素(Adamson et al. 1988;Kappen et al. 1998;Robinson et al. 2000;Schlensog et al. 2004;Wasley et al. 2012;Robinson and Waterman 2014;Cruz de Carvalho et al. 2017;Perera-Castro et al. 2020, 2021)。因此,这些因素处于中等水平的时期很可能是南极苔藓经历最高净光合作用和最小非生物胁迫的时期(Lewis Smith 1999;Perera-Castro et al. 2020, 2021)。苔藓的冰点大约在- 3至- 8°C之间,不同种类或不同苔藓健康状态(与可溶性碳水化合物含量有关;Melick and Seppelt 1992)。然而,一旦冻结,它们就进入生理休眠状态(Kappen和Schroeter 2002),因此它们通常不受环境温度、光线或水条件的影响。在这些休眠期之外,当苔藓被解冻(高于它们各自的冰点),光合作用可以在低至5°C的冠层温度下恢复(Lewis Smith 1999;Perera-Castro et al. 2020),这可能发生在气温低至- 2°C时(Randall 2022)。这种差异是通过改变苔藓冠层小气候的策略产生的。这些策略是避免极端寒冷和干燥的机制,为苔藓的生长和生产力提供了更好的条件。
有利小气候的发展是通过个人和社区层面的策略来实现的,这些策略旨在最大化热量积累和最小化热量损失。在单个配子体水平上,水合苔藓叶子的结构是这样的,以增加可吸收阳光的表面积。最重要的是,苔藓叶片的深色色素沉着降低了单个叶片和整个苔藓冠层的反照率,因此增加了对阳光的吸收和随后的热量增加(Malenovsky et al. 2015)。在群落层面上,密集的配子体形成了草皮结构,通过减缓空气和热量在苔藓树冠周围空气空间的湍流传递来减少热量损失。这种结构也减少了热量和水分的蒸发损失。因此,这些策略在苔藓叶周围创造了一个温暖潮湿的小气候。通过这些机制,当环境温度接近0°C时,南极苔藓可以在充分阳光下达到20-30°C的冠层温度(图4和5;朗顿和霍尔盖特1967;Lewis Smith 1999;Perera-Castro et al. 2020;Gemal et al. 2022),特别是在面向北部和东部的地形或微观地形方面(Randall 2022)。
图4
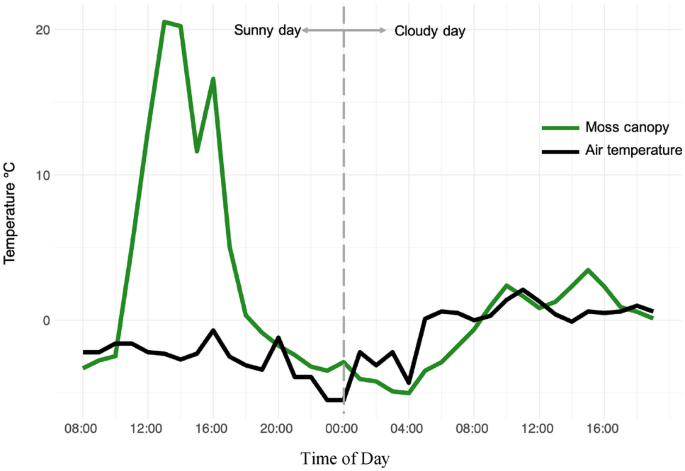
南极苔藓冠层温度和气象站气温在晴天和阴天的逐小时时间序列。在2022年2月7日至8日连续两天,在南极洲东部凯西站附近,用热电偶导线插入2 mm的南极裂子光合冠层,测量了苔藓冠层温度(n=36),夜间黑暗时间为3.5 h,将黄昏和黎明分开。凯西站自动气象站(AWS)同期的气温观测资料。所有数据都是在澳大利亚东部夏令时(AEDT, UTC+11)在凯西站测量的,大约比太阳时间早4小时。绘制的数据被调整为与太阳时间(UTC+7)一致。资料收集方法的详情载于补充资料
图5
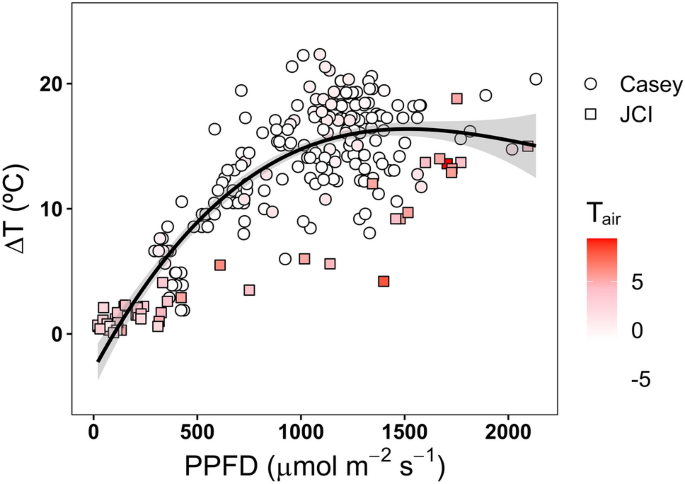
苔藓表面温度与空气温度之差(ΔT)作为光合光子通量密度(PPFD)的函数。符号阴影表示空气温度箱(< - 5°C, 0°C, - 5 - 0°C, 0 - 5°C和> 5°C)。气温越高,温差越小。来自Perera-Castro等人的Casey和JCI站合并数据(2020年,2021年)
通过改变苔藓冠层内的小气候,苔藓创造了一种不同于更广阔的南极气候的气候(图6;朗顿和霍尔盖特1967;Lewis Smith, 1999)。在夏季生长季节,空气温度显示出相对狭窄的范围,温度通常为零度或零度以下(图6)。然而,在苔藓冠层测量的温度显示出相当高的最高温度,高达20°C(图6),与最佳光合作用温度非常相似(Perera-Castro et al. 2020)。重要的是,这些温暖的小气候条件构成了在更广泛的气候条件之外的新的热气候条件(图6),扩大了环境的热范围,并为原本不会发生的最佳光合作用提供了机会(Pannewitz et al. 2005;Gemal et al. 2022;兰德尔2022)。然而,这些最高温度只在苔藓处于阳光直射下的短时间内出现(Longton 1974;Pannewitz et al. 2003),而在大多数情况下,光合作用可能会受到低温的极大抑制(Kappen and Schroeter 2002;Pannewitz et al. 2003;Perera-Castro et al. 2020;Gemal et al. 2022)。
图6
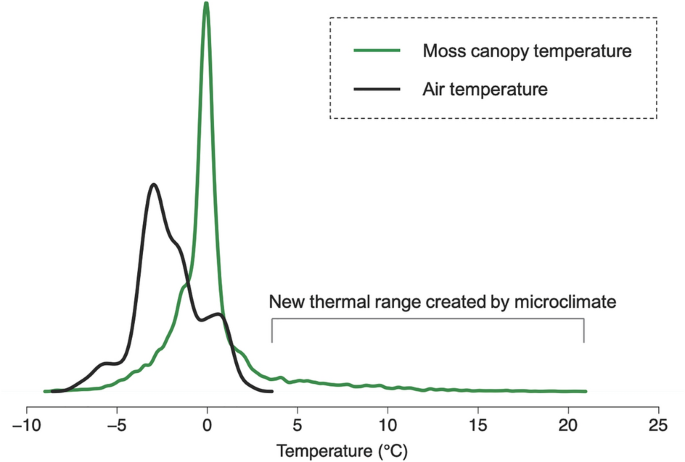
南极苔藓冠层温度和气象站气温密度图。于2022年2月6日至22日,在南极洲东部Casey站附近ASPA135苔藓床的n=20个位置上,利用热电偶导线在南极Schistidium antarctii、Ceratodon purpureus和Bryum pseudotriquetrum的光合冠层中插入2 mm,间隔30 min测量了苔藓冠层温度(n=13,856)。凯西站自动气象站(AWS)在同一时间段内每隔30分钟进行一次气温观测。研究方法的详情载于补充资料
这些温度的变暖主要是由直接日照驱动的(Longton和Holdgate 1967;Longton 1974;Kappen et al. 1998;Perera-Castro et al. 2020;Baker et al. 2021;Gemal et al. 2022;兰德尔2022)。因此,苔藓积累热量的能力受到云和/或积雪覆盖的严重影响,这可以抑制苔藓在气温以上变暖(图4;朗顿和霍尔盖特1967),并限制光合作用的机会。南极洲经历了一些全球范围内季节性太阳角度和日光时数变化最剧烈的地区(Pannewitz等,2005;传达等人,2014;Gemal et al. 2022)。与低纬度地区相比,太阳仰角(天顶)相对于地平线的角度要低得多,这减少了到达南极苔藓生长的地面的光线量。然而,冻融循环导致苔藓草坪形成块状(南极洲西部)或脊状(南极洲东部)微地形(图1;Melick and Seppelt 1992;Lewis Smith 1999;洛夫洛克和罗宾逊2002;Porada et al. 2016;Park et al. 2018),可以使苔藓垂直于入射太阳辐射,最大限度地提高它们接收的光(Randall 2022)。因此,南极苔藓可以接收到非常高的光量,通常超过1000μmol m - 2 s - 1,有时达到2000μmol m - 2 s - 1 (Pannewitz等人,2003;传达等人,2014;Perera-Castro et al. 2020;Gemal et al. 2022;兰德尔2022)。正是在这些较高强度的太阳日照期间,苔藓达到了最高的冠层温度(图5)。
虽然较高的温度有利于较高的光合速率,但苔藓冠层的热状态在很大程度上受含水量的控制(Lewis Smith 1999)。温度和含水量的交互作用对与夏季融水流相关的苔藓和仅依赖降雪后融水的苔藓会产生不同的结果。在苔藓获得可靠水流的地区,水的缓冲作用强烈地抑制了苔藓冠层的变暖(和变冷)(Lewis Smith 1999;Pannewitz et al. 2003, 2005;Block等人,2009;Perera-Castro et al. 2022b)。在这些条件下,苔藓冠层温度通常要么与水温保持平衡,要么与水温密切相关(Pannewitz et al. 2003),这取决于饱和度的高低。对这些苔藓来说,干燥的风险很小。然而,光合速率可能受到水的冷却作用的抑制(Pannewitz et al. 2003),或者可能是由于过度饱和(Perera-Castro et al. 2020)。
相反,在远离连续水源的地区,苔藓通常依赖于降雪事件后覆盖的积雪融化。光通过积雪的传输可以到达下面的苔藓,并使苔藓冠层变暖,这取决于积雪的深度。来自苔藓冠层的热量可以融化下面的积雪,提供液态水(Melick and Seppelt 1992)。一旦苔藓得到水分,它们的叶子就会最大限度地吸收光线,进一步促进雪的变暖和融化。值得注意的是,当积雪从地下融化时,剩余的积雪可以提供“冰窖”效应(Schroeter等人,2021),允许光线进入,同时提供保护,免受干燥的环境空气,风和干燥(K?rner 2003)。也有证据表明,较暖的温度可能有助于从地面向上吸走水分,作为苔藓的水合来源(Noakes和Longton 1988)。从地下融化积雪或从地下吸取水分的能力对没有与融化的溪流、池塘或湖泊相连的苔藓尤其重要,因为它们可能是在生长季节获得液态水的主要机制。然而,正如温暖的温度有助于提供液态水一样,温暖的温度也与通过蒸发增加的水分流失率有关。对于暴露于自由空气而不与持续融水相连的苔藓,较高的冠层温度代表更大的干燥风险和光合能力降低(Kappen et al. 1998;Raggio et al. 2016;Randall 2022)和对光保护的更大需求。
实地研究表明,光合作用可以很好地免受过多的太阳辐射,部分原因是保护色素的增加(Searles et al. 2001;Newsham and Robinson 2009)。保护性类胡萝卜素,包括叶黄素和β-胡萝卜素,通常在高光合有效辐射下增加(Esteban等,2015),在暴露于高UV-B辐射(UV-BR, 280-315 nm)的南极植物中(Newsham 2003;Newsham et al. 2002;Robinson et al. 2005;Ruhland and Day 2001)。
虽然光是进行光合作用所必需的,但可见光和UV-BR波长都可以直接或通过产生活性氧(ROS)破坏光合作用装置。Takahashi and Badger 2011;Badmus et al. 2022)。其他压力源,如寒冷和干旱,通过减缓碳固定的酶促反应和光呼吸等保护过程,从而减少电子传递,从而加剧损害(García-Plazaola et al. 2012;Takahashi and Murata 2008)。如果吸收的光能没有迅速转化为电子传递,则在光系统II (PSII)中可以形成破坏性ROS (Takahashi and Badger 2011)。这些活性氧可能会氧化光合装置的成分,如叶绿素(Takahashi和Badger 2011)。类胡萝卜素,包括β-胡萝卜素和叶黄素可以通过清除ROS来减轻这种损害(Havaux et al. 2007),此外,后者在非光化学猝灭(NPQ)过程中以热的形式消散多余的光能方面发挥重要作用。
在叶黄素循环(VAZ)中,紫黄质(V)通过花青素(A)被酶促转化为玉米黄质(Z) (Demmig-Adams et al. 1990,2012,2020;Nichol et al. 2012)。在强光下,Z可以在5-15分钟内形成,但只有当强光在类囊体膜上产生pH梯度(?pH)时,Z才会以热的形式消散。该系统对波动的光照水平反应迅速;随着光照减弱,?pH松弛,光合效率迅速恢复,即使Z仍然存在(Niyogi et al. 2005;Demmig-Adams et al. 2012;Gerotto et al. 2012)。在大多数生态系统中,将Z转换回V是一个较慢的过程,需要在黑暗中过夜(Demmig-Adams et al. 2012)。苔藓具有两个光收获复合体超家族蛋白,在NPQ中起作用;保留藻类中发现的光收集复杂应力相关(LHCSR)蛋白和维管植物中常见的光系统II亚单位S (PSBS) (Pinnola 2019;Pedraza-González等人2023)。
在强光或其他环境压力下,VAZ池大小和Z浓度都会增加,从而加剧PSII的光损伤(Takahashi和Murata 2008)。某些压力因素,如寒冷和干旱,可以导致持续的Z积累。越冬针叶树有持续的Z浓度,不是在夜间黑暗中反转,而是在变暖中反转;耐干燥的隐植物(如南极地衣和苔藓)似乎在干燥过程中积累Z (Fernández-Marín et al. 2010, 2011;Verhoeven 2014, 2013)。由于诸如C. purpureus之类的苔藓在冻结时失去细胞水分,因此干燥和冷冻胁迫可能无法区分(Verhoeven 2014;lennnet et al. 2010)。南极苔藓植物在冻融循环和低温和高温强光条件下发生可逆光抑制(Lovelock et al. 1995a, 1995b;Kappen et al. 1989;Adamson et al. 1988)。
南极苔藓使其色素浓度适应季节变化和地点之间的变化,可能是对小气候变化的响应(见上文)(Schroeter et al. 2012;Snell et al. 2007;洛夫洛克和罗宾逊2002;Robinson et al. 2005;García-Plazaola et al. 2022)。当苔藓在漫长的冬季被冰雪覆盖时,它们的色素通过降低光合速率和类胡萝卜素浓度而增加叶绿素水平来适应阴暗的环境(1990年后;Post and Vesk 1992;Robinson et al. 2005)。然而,在南方的夏季,苔藓失去了保护层,暴露在强光下,再加上寒冷的温度和干燥事件。在这一点上,在南极苔藓中以Z形式持续的VAZ百分比通常很高(Lovelock et al. 1995b;洛夫洛克和罗宾逊2002;Martínez-Abaigar、Nú?ez-Olivera 2022;García-Plazaola et al. 2022),类似于太阳植物(Demmig-Adams and Adams III 1992;洛夫洛克和罗宾逊2002;García-Plazaola et al. 2022)。例如,当美国antarctici样本从田间到实验室,50%的VAZ池仍在低光+ Z 24 h后(洛夫洛克et al . 1995年)。因此,南极苔藓的色素浓度对变化的环境条件非常敏感,使它们能够在极端条件下适应和茁壮成长。
在Casey站的三个苔藓物种中,这些保护色素的变化是在两个对比鲜明的夏季生长季节中确定的(图7;Dunn and Robinson 2006;Turnbull et al. 2009)。这里我们关注的是黄叶素循环色素,因为它们在NPQ中的作用,而β-胡萝卜素是黄叶素色素的前体,可以作为有效的抗氧化剂直接中和活性自由基。1999-2000年夏季的特点是高臭氧损耗、高UV-BR和相对较低的夏季融水,在11月至3月期间只有41天的温度超过0°C(图2c)。在2002 - 2003年,异常臭氧消耗(Varotsos 2002)伴随着68天高于0°C和大范围融化(图2c)。
图7
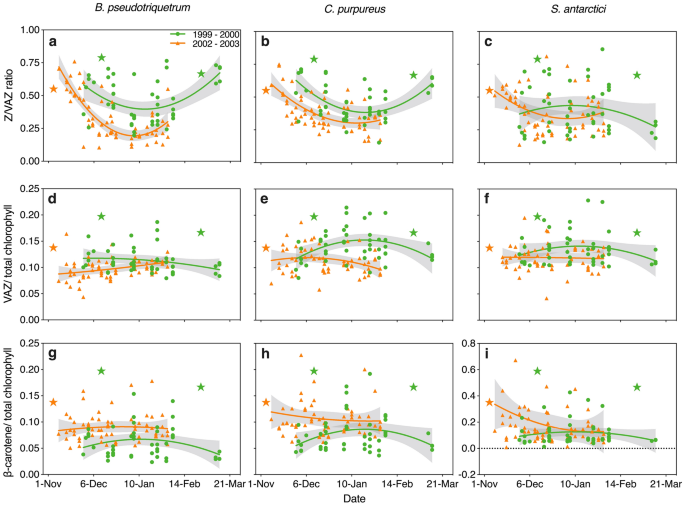
南极风车岛两个不同夏季(1999-2000年和2002-2003年)南极苔藓中光保护类胡萝卜素的变化。3种苔藓中叶黄素循环比例的变化分别为a?-c玉米黄质(Z/VAZ,)、d-f VAZ/总叶绿素和g-i β-胡萝卜素/总叶绿素比值(类胡萝卜素/叶绿素比值以mmol .mol?1表示)。二阶多项式回归显示为实线,当发现显著回归时,其95% CI为阴影。1999-2000年季节(每种物种n=47)表现出强烈的臭氧消耗和相对较低的“夏季融化”(见图2)。生长季节开始于12月11日,结束于2月27日,温度超过0°C有41天。整个季节,臭氧层厚度在313多布森单位(DU)的平均值上下波动。10月5日出现了187du的最小厚度,10月17日出现了427du的最大厚度。相反,2002-2003年夏季生长期(每种物种的n=64)臭氧消耗不典型,存在异常和广泛的融化。夏季开始于11月4日,结束于3月13日,气温超过0°C有68天。凯西上空臭氧柱的季节平均深度为339 DU。1月30日和2月20日的最小和最大臭氧深度分别为260 DU和440 DU。星形符号表示生长季节融化期的开始和结束,2002-2003年季节除外,由于采样时间有限,端点未标记。Dunn和Robinson(2006)以及Turnbull等人(2009)提供了气候和样本收集的进一步细节。提取方法见补充信息
玉米黄质在整个季节都存在于所有物种中,表明持续的Z积累(Demmig-Adams et al. 2012, 2020;García-Plazaola et al. 2012;Verhoeven 2014)。Z的保留在可预测的寒冷气候中是有利的,因为NPQ可以迅速激活(Demmig-Adams et al. 2012, 2020)。这一点很重要,因为即使在盛夏,夜间气温仍可能骤降至零度以下(图2a)。与2002-2003年较为温和的生长条件相比,1999-2000年较为紧张的环境条件下(较冷、较干燥和较强紫外线辐射)Z/VAZ总体水平持续较高。在2002-2003年间,高的Z转换速率被证明与降低的电子传递(ETR)相关(R2=0.1656, p < 0.001图8a)。
图8
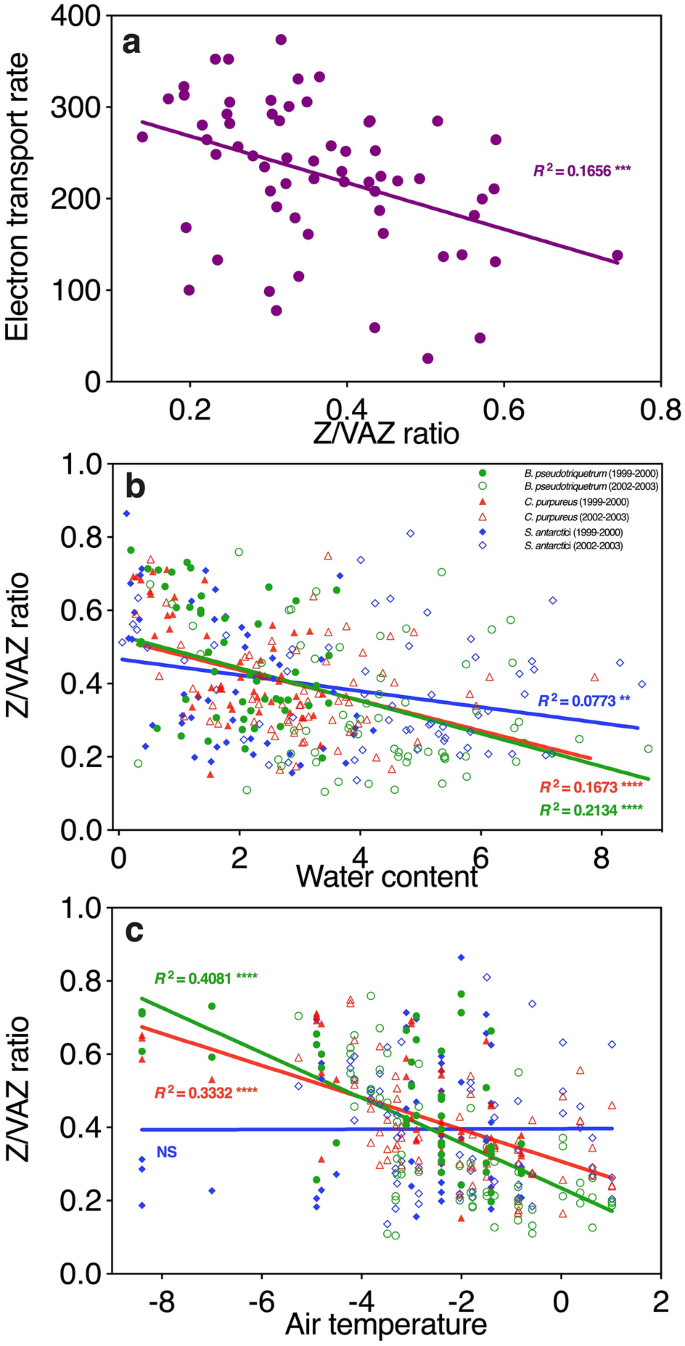
南极苔藓中光保护叶黄素(Z/VAZ)与叶绿素荧光(n=64) (a)、苔藓含水量(gH2O gdw?1)(b)和气温(°C) (C)测量的光合电子传递率之间的关系。图中显示了三个苔藓物种,即b . pseudotriquetrum (n=111,绿色)、C. purpureus (n=110,红色)和S. antarctici (n=108,蓝色)在两个季节测量的b - C之间的关系。然而,仅在2002-2003年收集了a的ETR数据,所有三个物种都表现出类似的反应
季节性的Z/VAZ(图7)表明,在整个夏季,假三鳃弓形虫和C. purpureus都有很强的能力来熄灭多余的光(图7a, b),这两个季节的趋势相似。Z/VAZ的比例在两季初最高(> 60%),但在季末也最高。在日长接近24 h且相对温暖湿润的盛夏,Z/VAZ下降到较为中等的水平(1999-2000年约为40%)。2002-2003年更有利的条件导致玉米黄质的再转化更大,在B. pseudotriquetrum中从70%到14%,在C. purpureus中从59%到24%(图7)。相比之下,特有的苔藓物种S. antarctii在季中表现出很大的变化,在季初持续高水平,在季末持续低水平。这可能反映了这三种物种在分布和偏好微栖息地上的差异,其中假三角弓形虫和C. purpureus比南极弓形虫占据更极端的微栖息地(Robinson et al. 2018;Wasley et al. 2006)。
VAZ/叶绿素比值没有明显的季节变化趋势,这种变化可能反映了不同微站点之间的差异。在1999 ~ 2000年季节,只有在仲夏季节,紫红色C. pupureus的数量呈显著上升趋势(P < 0.05)。同样地,β-胡萝卜素/叶绿素在假三角螺旋藻和紫螺旋藻中没有季节性变化趋势,但在南极螺旋藻中变化更大(图7)。南极螺旋藻中β-胡萝卜素/叶绿素含量似乎高于世界分布物种,并且在季节早期最高,在季节结束时最低。
对色素季节性变化的环境驱动因素也进行了研究。在允许收集类似数据(即空气温度和含水量)的情况下,将两个季节的数据合并。我们有选择地报告了各季节强劲、一致的趋势,承认R2很低。(图8;补充图S1)。紫外指数的相关性也显示在补充图S2中,但这些相关性弱于含水量和气温,并且只有一个物种是共同的。在所有三种苔藓中,保护形式(Z/VAZ)的叶黄素比例随着苔藓变湿而下降(图8b),这与干苔藓需要最多的光保护以及在潮湿条件下更大的酶活性一致。南极S. antarctic的VAZ/叶绿素与含水量也呈负相关(R2=0.0486, P < 0.05, Supplementary Fig. S1)。与之相反,伪三quetrum和C. purpureus的β-胡萝卜素/叶绿素与含水量呈正相关(R2=0.1271, P < 0.001, R2=0.0697, P < 0.01, Supplementary Fig. S1)。
在较温暖的条件下,伪三角锥虫和紫锥虫中保护形态的叶黄素比例(Z/VAZ)下降(R2=0.4081,伪三角锥虫P < 0.0001, R2=0.3332,紫锥虫P < 0.0001),但南极南极锥虫没有下降(图8c)。β-胡萝卜素/叶绿素与气温呈显著正相关(R2=0.0771, P < 0.01),但与其他两个物种无关(补充图S1)。
通常,空气温度和水的参数同时变化,例如,冻结会减少苔藓的含水量,但苔藓在相对温暖的情况下也可能是干燥的。综合这些数据,似乎表明含水量是更大的驱动因素。这些关系可能解释了图7所示的趋势,干燥的苔藓(在季节的早期和晚期),在仲夏不得不比潮湿、温暖的苔藓消散更多的多余光,因此需要更多的玉米黄素(在南极南极的情况下,相对于叶绿素,也需要更多的总叶黄素循环色素)。这也与所有物种的数据一致,当电子传递速率最高时,Z/VAZ最低(图8a;仅限2002-2003赛季)。
特有种南极s与其他两种不同的是,在季节结束时Z/VAZ值较低,对气温没有反应。这可能是因为它占据了最低的位置,可能在更多的季节里保持水分状态。南极血吸虫对气温的反应也可以用湿苔藓的缓冲作用来解释,因为对这个物种来说,苔藓的冠层温度范围可能不那么极端。为了解决这个问题,需要进一步研究色素对小气候的反应。
在盛夏,高水平的光合有效辐射自然会带来更高水平的紫外线辐射。然而,南极洲正上方平流层臭氧的减少给生活在独特的南极气候中的苔藓带来了另一个挑战。平流层中的臭氧分子层是地球抵御有害太阳辐射的屏障之一,尤其是波长较短的紫外线,如UV-B(280-315纳米)和UV-C(100-280纳米)。自20世纪70年代以来,由于人类制造的氯基气溶胶到达平流层,臭氧分子在南方春季(9月至11月)发生了催化分解(Bernhard et al. 2023)。这已经耗尽了臭氧层,降低了它作为紫外线过滤器的效力,使南极苔藓受到更高和有害剂量的紫外线- b辐射;其水平可损害重要的细胞内容物和过程,如DNA、叶绿素和光合作用(Rozema等人,2005;Seppelt et al. 2011;Newsham and Robinson 2009)。考虑到它们缺乏结构性防御,南极苔藓采用什么机制在UV-B辐射升高的情况下生存?
通过产生和储存被称为紫外线吸收或屏蔽化合物的特殊化合物,苔藓通常可以很好地保护免受UV-A和UV-B辐射(Newsham和Robinson 2009;Robinson和Waterman 2014),并通过激活抗氧化酶和DNA修复过程(Martínez-Abaigar和Nú?ez-Olivera 2022;Wang et al. 2021)。有充分的证据表明,一些南极物种利用吸收紫外线的化合物作为直接保护机制,吸收有害的紫外线波长,并将光合作用有用的可见光传输到叶绿体(Newsham和Robinson 2009;Davies et al. 2020;Waterman et al. 2018,2017;Dunn and Robinson 2006;Newsham 2003;Newsham et al. 2002;Clarke and Robinson 2008)。吸收紫外线的化合物似乎可以保护风车岛物种免受紫外线- b辐射升高下预期的DNA损伤,特别是当这些植物干燥时(Clarke and Robinson 2008;Turnbull et al. 2009)。
这些筛选化合物在南极苔藓植物中的衍生物主要是酚类或类黄酮类(Waterman et al. 2017;Ryan et al. 2009;Snell et al. 2009;Newsham 2003;Webby et al. 1996;Markham and Given 1988;Davies et al. 2020),其中一些具有抗氧化特性,还具有清除细胞内ROS的能力(Martínez-Abaigar和Nú?ez-Olivera 2022;Robinson and Waterman 2014);间接防止进一步的损害。其他抗氧化机制,如活化抗氧化酶,也可发生在南极苔藓中,如波利亚·努坦和山藓,以帮助抑制在过度光照和干燥等应激条件下形成的活性氧(Martínez-Abaigar和Nú?ez-Olivera 2022;Pizarro et al. 2019;Li et al. 2019)。一些苔藓物种,包括C. purpureus,也在其细胞壁中放置有效的吸收紫外线的化合物,为这些单细胞生物提供了比放置在液泡中的更好的防御策略(Clarke and Robinson 2008;Waterman et al. 2017)。由于吸收紫外线的化合物的积累,南极苔藓植物可以表现出红色的色素沉着(图3c;Newsham 2010;Snell et al. 2009;Waterman et al. 2018)。有证据表明,在干燥、营养剥夺和极端温度条件下,类黄酮等防晒霜可能会在苔藓中积累,再加上紫外线辐射(见综述Martínez-Abaigar和Nú?ez-Olivera 2022;Davies et al. 2020),它们可以用作苔藓健康状况的指标(Waterman et al. 2018;Malenovsky等人。2017)以及作为南极洲的气候代用物(Markham等人,1990;Ryan et al. 2009)。
南极土壤往往发育不良,养分相对贫乏,养分主要来自海鸟和哺乳动物(Erskine et al. 1998),这意味着植被通常位于筑巢地附近(Bokhorst et al. 2019)。在现存的企鹅群落中,大多数植物的营养负荷过高,这些地点也受到践踏(Cannone et al. 2022)。然而,古老的企鹅群落提供了丰富的风化鸟粪来源,凯西地区丰富的苔藓床是在3000-8000年前企鹅筑巢的地方发现的(图3a)。自上个冰河时期以来,随着冰川的消退,均衡隆起把陆地抬高,企鹅们搬到了附近岛屿的离岸地点。被遗弃的ad
海珊企鹅聚居地的标志是精心分级的巢石,以及为苔藓床提供营养的鸟粪(图3b)。对企鹅骨头和蛋壳的放射性碳年代测定证实了这种冻干肥料的年代(Goodwin 1993;Emslie和Woehler 2005),氮的稳定同位素可以用来表明,现在的苔藓从这种鸟粪中获取营养,并补充了来自当前企鹅群落的少量空气中铵(Wasley et al. 2012)。
在温室气体增加和臭氧消耗的双重驱动下,南极洲正在发生气候变化(Robinson and Erickson 2015;Chown et al. 2022;Wmo 2018、2022;Ranasinghe et al. 2021;Fox-Kemper et al. 2021;Constable et al. 2022)。半岛和南极洲西部经历了快速变暖,包括冰盖减少,这为殖民开辟了新的土地(Lee et al. 2017;Cannone et al. 2022;Colesie et al. 2023)。非洲大陆的东部一直较冷,部分原因是臭氧消耗(Robinson and Erickson 2015;WMO 2018),但对南极洲大陆未来变暖进行了预测(Chown et al. 2022;Ranasinghe et al. 2021;Constable et al. 2022)。这将为苔藓的定植开辟新的区域,但正如Lee等人(2022b)所讨论的那样,目前尚不清楚这是否对所有物种都有益。这在很大程度上取决于新的无冰区是否能保持良好的水源供应,是否有营养物质存在。即使条件有利,繁殖体也必须分散到新的区域,并且可能受到干扰的威胁(Lee et al. 2022b;Cannone et al. 2022)。
气候变化导致南极洲大部分地区的净雪积累,并导致南极海洋地区的气温升高(gutisamurez等人,2021;Ranasinghe et al. 2021;Constable et al. 2022)。南大洋的风速增加,特别是在南部夏季(Chown et al. 2022;世界气象组织2018)。臭氧消耗增加了南极洲上空的UV- b辐射水平,初夏的UV指数最近显示超过了中纬度地区的测量值(Bernhard et al. 2023)。近几十年来,温室气体浓度的增加和臭氧消耗导致西风急流向极地移动,这与南环模(SAM)气候模式的正相位增加有关(Abram et al. 2014;Robinson and Erickson 2015;Wmo 2018、2022;Chown et al. 2022)。风以多种方式影响供水,从吹雪到水融化后的蒸发。
极端气候事件在南极洲也变得越来越普遍。在2019/20年,整个夏季南极洲都记录到了异常高温,带来了新的最高温度记录(18.3°C, Robinson et al. 2020;Wille et al. 2019)。2022年秋季,一股席卷南极洲的广泛热浪为秋季带来了反常的温暖气温和额外的降水(Barnes et al. 2023)。
在过去的半个世纪里,臭氧消耗和全球变暖都导致了风车群岛的干燥趋势(Robinson et al. 2018)。从西边几千公里的另一个地点,维斯福尔山的莫塞尔湖(图9)观察到,大型苔藓床的长期干燥可能更为普遍。这些南极苔藓床的未来轨迹显然与未来的气候变化有关,特别是气候变化如何影响东南极洲的水平衡(Guglielmin et al. 2014;Robinson et al. 2018;Bergstrom et al. 2021)。
图9

南极洲维斯特福尔山莫塞尔湖的苔藓健康状况从健康(1998年)下降到垂死(2005年、2018年和2019年12月),可能是因为湖泊周围以前广泛的苔藓床的供水减少,以前被冰川融化填满。下图(2020年1月)显示了2020年夏季热浪洪水后进行的一些修复。(图片来源:约翰·弗兰奇,马库斯·索尔顿,达纳·伯格斯特罗姆;经Bergstrom et al. 2021许可修改)
虽然水资源供应可能是南极洲陆地生物多样性模式的主要驱动因素(传达等人,2014年),但在南极洲无冰地区以及北极的未来模型中,这一问题的解决相对较差(康斯特布尔等人,2022年)。研究南极陆地生态系统未来的一个关键领域是,随着无冰区的扩大,水的可用性会发生什么变化(Lee et al. 2017,2022b;Guglielmin et al. 2014;Cannone et al. 2016, 2022;Loisel et al. 2017;Torres-Mellado et al. 2011;Favero-Longo等,2012;Yu et al. 2016;Colesie et al. 2023)。
目前,水的主要来源是夏季提供融水的冰雪堤岸。植被和无脊椎动物群落通常与这些季节性融水来源联系在一起。如果有更多的降水,天气变得更湿润,我们预计会增加生长和相关的绿化,就像在南极海洋观察到的那样(Amesbury等人,2017;Royles et al. 2013;Cannone et al. 2022;Colesie et al. 2023)。在东南极洲,雪堆随着变暖而退缩,如果降水不增加,现有的群落将不得不改变以跟上退缩的步伐。正如全球其他积雪为主的地区所确定的那样,早春融雪的到来,以牺牲夏季流量为代价,导致峰值流量增加,是一种威胁(IPCC 2021)。在麦克默多干谷,“2002年洪水年”剧烈的冰川融化导致了水供应的逐步变化,在接下来的几年里,蓝藻和无脊椎动物群落发生了明显的物种特异性变化(Gooseff et al. 2017)。在2020年热浪引发的洪水期间,南极洲东部Vestfold Hills的一个巨大的、以前垂死的苔藓床开始变绿(图9)(Bergstrom et al. 2021)。在风车群岛,大面积的苔藓已经从我们的长期监测地点移走,大概是由类似的洪水事件造成的(图1n)。这种类型的干扰可以使苔藓移动到新的位置(Skotnicki等人,1999年),但如果苔藓沉积在一个新的不利位置,也可能导致植被覆盖的损失。
在这个已经极度缺水的栖息地,影响供水的环境因素将对苔藓的分布、生长和生存产生深远的影响。虽然我们认识到南极植被的未来将取决于水的可用性,但这可能是气候模型中最不确定的因素。这是由于对输入(如雪和雨的降水)的预测存在不确定性,对当地积雪及其融化特征以及生态系统中保留了多少水的了解不足。更好的降水模型和更精细的小气候和水文模型将有助于我们理解水在未来将发挥的作用。除了降水等直接输入的变化外,温度和辐射模式都影响融雪。温度升高,特别是由强辐射(图5)驱动(图9),导致雪融化增加,这将是正的(图9),前提是它不会导致破坏性洪水或过快排水(要么通过永久冻土融化;Guglielmin et al. 2014,或来自集水区)。升高的温度和风速也增加了苔藓床上水分的蒸发,导致光合作用和生长所需的水分减少。蒸发量的增加会间接影响云量(Mendoza et al. 2021),这将减少提供光合作用、冠层温暖和供水的可用辐射的时间和数量。
臭氧消耗在春季(10月)达到最大,此时太阳角度和辐射水平较低。在春天,南极的苔藓也会被积雪所保护。然而,在过去几年中,臭氧消耗已经延伸到初夏,这导致南极测量到相当极端的夏季紫外线辐射(Bernhard et al. 2023)。这是一个令人担忧的发展,因为时间恰逢苔藓从积雪下出现。具有讽刺意味的是,尽管《蒙特利尔议定书》(及其修正案)非常成功,南极洲上空的臭氧层正在开始恢复,但我们面临的情况是,南极洲的动植物目前可能暴露于自20世纪70年代首次观察到臭氧消耗以来最高的紫外线b水平。如上所述,一般来说,南极苔藓似乎很好地保护了UV-B辐射,但它确实有助于综合环境压力,并导致碳增益略有减少(Newsham和Robinson 2009)。如果全球变暖和极端高温事件的增加导致雪提前融化,南极植物所经历的累积紫外线剂量将来可能会增加。
生理学证据表明,南极植物的矮小和小气候使它们能够保持远高于空气温度的表面温度(高于环境温度> 10°C),因此它们具有与温带植物相似的代谢最佳值(> 20°C, Perera-Castro et al. 2020)。这是对当前气候的极好适应,但我们不知道苔藓对热浪中出现的更高温度的反应如何,比如2019-2020年夏季经历的热浪(Robinson et al. 2020;González-Herrero et al. 2022)。温度是否会超过极限并造成有害的损害,或者苔藓是否能够通过使用它们的一套光保护化合物来避免或应对额外的压力?为了模拟南极苔藓未来的生长速率,需要更好地了解光合作用和呼吸作用对温度升高的反应。
在这种快速变化的环境中,随着竞争过程的改变,一些本地生物将成为赢家,而一些本地生物将成为输家(Lee等人,2022a, b)。例如,在风车群岛,本地的广域苔藓物种正在转移到以前由地方性苔藓物种主导的地区(Robinson等人,2018),一些物种在车站周围新受干扰的地区定居的能力增强(例如,Casey站的b . pseudotriquetrum;罗宾逊通讯公司)。在半岛上,苔藓和地衣也容易受到本土被子植物扩张、动物干扰增加和入侵物种风险增加的影响(Chown et al. 2022;Cannone et al. 2022;Bokhorst et al. 2019;Colesie et al. 2023)。
南极苔藓表现出一系列的生理策略,使它们能够在恶劣的条件下维持在南极洲的栖息地。气候变化正在改变这种环境,其中一些适应在未来可能不那么有利。了解小气候在改善恶劣条件中的作用、无冰区的未来特征(Lee et al. 2022b)以及苔藓物种能够适应的程度对于准确预测它们的未来至关重要。
摘要。
介绍
数据可用性
参考文献。
致谢。
作者信息
道德声明
相关的内容
# # # # #
以下是电子补充材料的链接。
ccDownload: /内容/ pdf / 10.1007 / s11120 - 023 - 01040 - y.pdf



