本研究旨在研究抑制BMS-345541介导的IKK激酶磷酸化对细胞防御系统、抗炎反应和HSP90活性的影响。分析是在A549细胞系中进行的,因为这种细胞携带一个纯合的Keap1突变(G333C),改变了它与Nrf2的相互作用。最近的研究表明,Keap1、HSP90蛋白和IKK激酶相互作用,特别是Keap1蛋白参与HSP90和抗氧化途径的调控。采用实时和免疫印迹法检测COX2和HO1的活性,同时检测热休克蛋白HSP90诱导型的合成和活性。用IKK激酶抑制剂预处理被证明是一种降低炎症级联活性的保护手段,从而防止过量促炎分子的形成。将IKK激酶抑制剂BMS-345541添加到培养的A549细胞中,然后添加大肠杆菌脂多糖(LPS)。BMS-345541在1,25 - 5μM浓度下孵育1 - 24 h后测定细胞活力。结果发现,1μM浓度对细胞活力没有显著影响(数据未显示)。结果表明,1 μM的BMS-345541处理诱导IKK磷酸化抑制。在BMS-345541和LPS处理的A549细胞中,COX2活性未被诱导:mRNA和蛋白水平未升高,而HSP90、HO1蛋白和mRNA水平升高。结果表明,IKK抑制在减少炎症反应中是有效的,这要归功于热休克细胞防御系统和抗氧化途径的机制。
在过去的20年里,关于NF-kB/IKK在炎症、肿瘤发生和癌症进展等最重要的细胞过程中的作用的知识已经非常令人印象深刻。特别是,很明显,这些进程是密切联系和相互关联的[1,2,3]。在哺乳动物中,NF-kB复合体由五种单体蛋白(p65 / RelA、RelB、cRel、p50和p52)组成,形成同型二聚体或异型二聚体,它们以不同的亲和力与DNA结合。NF-kB的“典型”调控是复杂的,并由一个由NEMO支架/适配器蛋白(IKKγ)和两个i - κ b激酶(IKKα和IKKβ)组成的蛋白激酶复合物介导;因此,它也被称为NEMO依赖。IKKα是一种85 kDa的蛋白,最初被鉴定为一种功能未知的丝氨酸-苏氨酸。IKKβ是ikk α相关的87 kDa蛋白。IKKγ (50-52 kDa)包含几个螺旋缠绕的n端螺旋基序,一个LZ和一个c端锌指。IKK激酶通过位于激活t环中的丝氨酸磷酸化而激活,其复杂的机制尚未完全了解。这种磷酸化可能涉及构象变化,导致激酶的激活。在细胞稳态条件下,NF-kB通过与IkB家族的抑制分子相互作用,在细胞质中保持失活[4,5]。当IkB被磷酸化和多泛素化时,它被蛋白酶体降解,从而允许NF-kB的释放,这些NF-kB可以转位到细胞核中并激活其靶基因的转录,与称为反应元件(RE)的DNA序列结合。DNA / NF-kB复合体的形成涉及其他蛋白质作为共激活因子,从而允许靶基因的激活和转录。此外,IKK复合体作为NF-kB激活的信号中枢和其他信号级联的接口具有关键作用,如mTOR和MAPK通路[6,7]。多项研究指出,IKKβ通过磷酸化抑制肿瘤抑制因子参与促进致瘤性;因此,IKKβ被认为是一种致癌激酶[5,8]。最近,IKK复合物与Nrf2的主抑制因子Keap1蛋白相互作用[9,10,11,12]。KEAP1和NRF2是调控氧化应激通路的两个关键基因。核因子红系2相关因子2 (NFE2L2或NRF2)被认为是抗氧化和亲电应激的主要抗氧化转录因子之一[13,14]。当细胞暴露于氧化应激时,KEAP1发生构象变化并与NRF2分离[15]。Nrf2由Keap1-Nrf2复合体释放,从细胞质转运到细胞核,激活相关抗氧化基因的表达[16]。此外,Keap1作为IKKβ的E3连接酶,因为其ETGE-Motif-NQE36TGE39-与Nrf2蛋白中的etge - motif同源,因此Keap1被认为是IKKβ的相互作用蛋白[17],Keap1基因的突变或改变与癌症或深度改变的细胞应激反应相关[18]。最近在RAW264.7细胞中进行的一项研究[9,10]表明,当Keap1功能活跃时,IKK激酶被canonic lps信号激活。Keap1是炎症和氧化应激相互作用的关键蛋白。有趣的是,Hsp90和KEAP1在热休克时相互作用,导致NRF2激活[19],环境氧化还原变化可诱导热休克基因[20,21]。因此,我们分析了IKK激酶、HSP90与COX2和血红素加氧酶-1 (HO1)酶介导的抗炎反应之间的串扰。更准确地说,我们在Keap1等位基因突变的细胞系A549中使用BMS-345541诱导IKK磷酸化抑制[22],以观察其对潜在分子机制的影响。
A549细胞系(由Francesca Sardina和Cinzia Rinaldo (IBPM-CNR, Roma, Italy)提供)在添加10% v/v热灭活胎牛血清(FBS)和抗生素(100 U/ml青霉素和100 μg/ml链霉素)的Dulbecco 's Modified Eagle培养基(DMEM)中,在37℃、5% CO2的湿化气氛中培养。FBS、DMEM、青霉素和链霉素(10,000 U/ml)购自GIBCO (Grand Island, NY)。大肠杆菌血清型O55:B5的LPS购自Sigma-Aldrich, Inc (St. Louis, MO)。TRIzol购自Invitrogen公司,quantiinova RT - PCR试剂盒购自德国Hilden公司,BrightGreen 2X qPCR MasterMix-ROX购自加拿大ABM公司。硝化纤维素印迹膜购自Amersham propan (Buckinghamshire, UK)。BMS- 345,541是从Sigma-Aldrich公司(St. Louis, MO)购买的。
A549细胞在添加10%牛血清的DMEM中以1 × 106个/孔的比例在6孔板中培养过夜。在1 μM BMS- 345,541存在或不存在的情况下,分别用100 ng/ml LPS或不加LPS(阴性对照)处理细胞。100 ng/ml LPS刺激细胞4 h作为阳性对照。刺激4小时后,将细胞从孔中分离,用PBS洗涤一次。按照说明书用TRIzol分离总RNA,用紫外吸收分光光度法定量,用quantiinova RT PCR试剂盒逆转录。使用BrightGreen 2X QPCR MasterMix-ROX对每个基因的每个cDNA样本进行三次QPCR。从Qiagen购买的定量引物套装为:
Hsp90 NM005348.2 F: 5 ' -CGA TGA ATA TGC CAT GAC T-3 '
R: 5 ' -tcc TCT - cca g-3 '
Cox2 gi:31,981,524 f:5 ' -cag aca aca taa act GCG cctt-3 '
R: 5 ' - gaca CCT CTC cac caa tgacc -3 '
Ho1 nm_010442.1 f: 5 ' -cactctggagatgacacctgag-3 '
R: 5 ' - gtgttcctctgtcagcatcacc3 '
HPRT nm194 f:5 ' -gct数据TCT TTG CTG acc TGC tg-3 '
R: 5 ' -aat tac TTT那GTC CCC TGT tgg -3 '
计算阈值周期(CT)值与管家基因Hprt的关系。为了报告结果,将所有数据归一化为Hprt, Hprt被赋予任意表达水平10000,基因相对表达值按以下公式计算:相对表达10000 /2 CT,其中CT为基因CT/Hprt CT。根据应用生物系统实时PCR软件。熔化曲线分析验证所得PCR产物的纯度和大小。每个基因和治疗至少检查了三个不同的生物样本(每个样本一式三份)。
A549细胞(1 × 107个细胞)在10 cm培养皿(Falcon)中培养24 h, BMS- 345,541 1 μM处理1 h后,LPS 100 ngr/ml孵育4 h,冷PBS洗涤2次。使用RIPA缓冲液(Cell Signaling Inc.)获得全细胞裂解物。Beverly, MA, USA)。用Bradford法测定细胞裂解液的蛋白浓度。在8-16%的Tris-Glycine Gel (BioRad)凝胶上电泳分离一定量的蛋白质(30 μg),转移到硝化纤维素膜上。将膜与3% BSA在TBS缓冲液(0.1% v/v)中室温孵育1小时,以阻断非特异性结合,并与合适的一抗在1% BSA的TBST中孵育(0.01% v/v)。识别HSP90、IKKα/β、COX2、HO1和β-actin的多克隆抗小鼠抗体购自Santa Cruz Biotechnology (Santa Cruz, CA, USA);识别p-IKKα/β的多克隆抗兔抗体购自美国马萨诸塞州Cell Signaling Technology公司。二抗Alexa Fluor 680山羊抗兔(1:2000)和Alexa Fluor 800兔抗鼠(1:5000)(Molecular Probes, Life Technologies, Carlsbad, CA, USA)室温孵育1小时。使用奥德赛红外成像系统(LiCOR Bioscience, NE, USA)进行密度分析。
统计分析。所有资料与各自对照组比较,采用单因素方差分析(one-way analysis of variance, one- ANOVA),采用OriginPro 7.5统计程序进行Tukey’s多重比较检验,显著性水平设为P < 0.05。每个结果以三个独立重复实验的平均值±SE报告。
摘要
介绍
材料与方法
结果
讨论
数据可用性
参考文献
致谢
作者信息
道德声明
搜索
导航
#####
IKK激酶是NF-κB复合物的主要激活因子。IKK复合物由两个催化亚基(IKKα和IKKβ)和一个调节亚基(IKKγ/NEMO)组成。在过去的二十年中,许多研究都集中在设计蛋白激酶抑制剂作为潜在的药物靶点和药理学药物上。LPS前1小时,用BMS-345541 1μM处理细胞,未处理细胞作为阴性对照。制备总提取物,免疫印迹分析IKKα/β。如图1a所示,当BMS-345541处理发生时,IKK磷酸化被强烈抑制。众所周知,在体内和体外,LPS都是IKK激酶的强大磷酸化激活剂:在我们的研究模型中,BMS-345541处理后的p-IKK蛋白水平虽然有LPS存在,但明显下降。我们的研究结果与文献数据一致,表明BMS-345541抑制lps诱导的促炎反应,因为它诱导IKK复合物磷酸化的耗竭。我们测试了bms -345541在A549肺癌细胞系中也能降低IKK活性。图1b显示了IKK激酶的免疫印迹对照。
图1
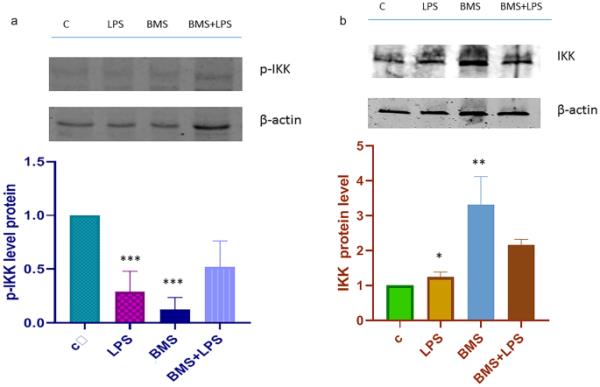
a免疫印迹分析p-IKK α/β。分别用BMS-345541 1 μM和不加BMS-345541 1 μM处理A549细胞24 h,然后用100 ngr/ml LPS处理4 h,获得全细胞裂解液,并用抗p- ikk α/β抗体(Ser176/180 CellSignaling)进行分析。代表性免疫印迹显示p-IKKα/β蛋白水平的结果。直方图代表用肌动蛋白归一化后三个重复的平均值±SD。与设定为1的对照相比,以任意单位报告的蛋白质水平增加或减少了两倍。星号(***)表示组间差异显著(*** p < 0.001), b免疫印迹分析A549细胞中IKK α/β。A549细胞按上述方法处理。未受刺激的细胞作为对照。获得全细胞裂解物,并用抗IKK抗体(C-20, Santa Cruz Biotechnology)进行分析。直方图显示了IKK的相对蛋白水平。所示数据代表三个独立的实验。β-肌动蛋白免疫标记作为归一化对照。数据以平均值±SD报告;星号(*)表示LPS vs对照组;“**”表示BMS vs C。
抗氧化反应元件(ARE)的转录激活在激活抗亲电试剂和活性氧(ROS)毒性的防御机制中起着关键作用。Nrf2是一种Cap-N-Collar转录因子,作为一种非常有效的信号换能器,通过ARE调节转录来响应亲电试剂和ROS。受调控的基因包括解毒酶和抗氧化基因,提供对氧化损伤的保护。COX酶存在于COX1和COX2两种亚型中。COX1在许多组织中组成性表达,并负责维持正常的前列腺素生理水平。可诱导的COX2亚型产生与炎症进展和疼痛相关的前列腺素。在这项研究中,我们通过将细胞暴露于IKKα和IKKβ催化亚基的高选择性抑制剂BMS-345541(1μM浓度),重点研究了IKK激酶抑制剂BMS- 345,541在A549细胞中介导的COX2活性在各种生物学水平上的影响,包括转录本和蛋白质。提取LPS (100 ng/ml)作用4 h的A549细胞总蛋白和RNA;在BMS- 345,541暴露1小时后,对细胞进行LPS处理,并将免疫印迹和qPCR结果与未暴露的BMS- 345,541细胞进行比较。COX2蛋白水平分析在各组间没有明显变化(见图2)。同样,以COX2特异性引物和HPRT作为内标扩增cDNA, lps处理的A549细胞中COX2 mRNA的转录甚至没有增加(数据未显示)。这些结果表明,BMS- 345,541处理的A549细胞不会诱导由COX2激活介导的促炎反应。
图2
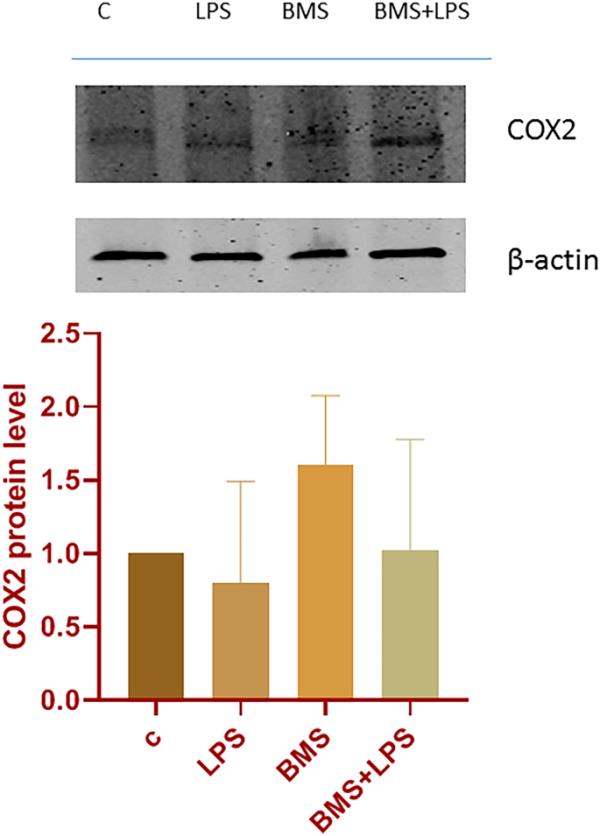
A549细胞系COX2蛋白的免疫印迹分析。A549细胞按上述方法处理。提取总蛋白,进行COX2蛋白水平的免疫印迹分析。密度分析如图所示;各组间无显著差异。
血红素氧化酶-1 (HO1)是抗氧化和抗炎反应中最重要的酶之一。在炎症发生时,HO1的有益作用与血红素群的降解及其抗炎产物胆绿素和CO有关。因此,HO-1的诱导在抗氧化反应中具有突出作用,其诱导有助于对比炎症过程。因此,我们通过免疫印迹和qPCR分析转录物和蛋白水平,结果如图3所示。值得注意的是,BMS- 345,541处理诱导HO1 mRNA和蛋白水平升高。
图3
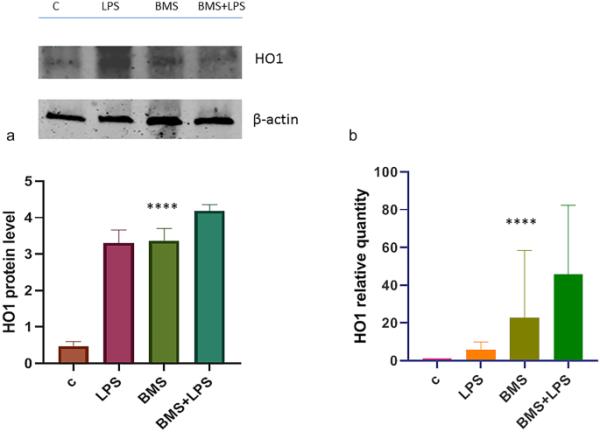
a A549细胞系HO1蛋白的免疫印迹分析。分别用BMS-345541(1μM)和不加BMS-345541(1μM)处理A549细胞24 h,再用LPS (100ngr/ml)处理A549细胞4 h,提取总蛋白并进行HO1蛋白水平的免疫印迹分析。用肌动蛋白归一化后的密度分析如图所示。所示数据代表了三个独立的实验。数据以平均值±SD报告;星号(****)表示组间差异显著(**** p < 0.001)。b a549细胞HO1 mRNA表达分析。细胞按上述方法处理。提取总RNA,用HO1引物qPCR分析cDNA。未受刺激的细胞作为对照。水平以任意单位表示,与假定为1的控制相比,增加了几倍。所示的数据代表三个独立的实验,每个实验都进行了三次重复。星号(*)表示组间差异显著(****p < 0.0001)。
热休克反应是最重要的细胞保护途径之一。氧化条件和一些化学物质都是引起细胞内稳态改变和细胞应激的因素。HSP90蛋白的活性提供了一个强大的反应,帮助细胞在损伤时存活,因此保持其功能是极其重要的。许多先前的研究表明,HSP90的调控依赖于Keap1和IKK;因此,我们正在Keap1功能丧失和bms -345541介导的IKK激酶抑制的体外模型中研究HSP90的活性。分别用(或不加)1μM BMS-345541和100ngr/ml LPS处理A549细胞4小时,提取总蛋白和RNA。进行免疫印迹和qPCR分析,结果如图4所示。各组HSP90蛋白水平差异有统计学意义。图4a显示BMS-345541和LPS处理的A549细胞中HSP90蛋白水平升高。为了证实这一结果,我们对HSP90 mRNA进行了qPCR分析。以Hsp90和HPRT特异性引物为内标扩增cDNA,结果表明BMS-345541和LPS处理显著触发Hsp90 mRNA转录。这些结果非常重要,因为它们表明HSP90基因调控与IKK激酶没有紧密联系,然后IKK磷酸化级联的阻断不会关闭细胞的防御能力(图5)。
图4
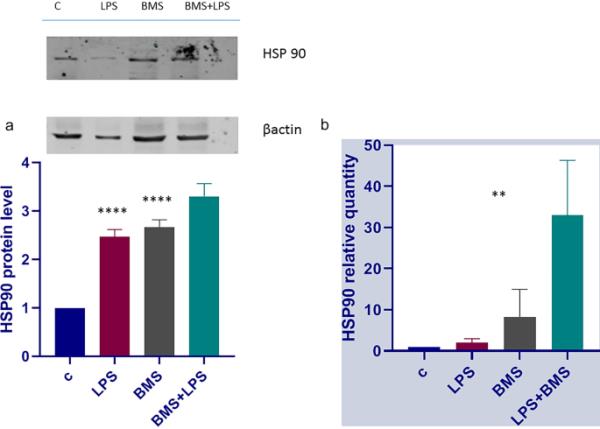
a A549细胞株HSP90蛋白的免疫印迹分析。分别用BMS-345541(1μM)和不加BMS-345541(1μM)处理A549细胞24 h,再用LPS (100ngr/ml)处理A549细胞4 h,提取总蛋白并进行HSP 90蛋白水平的免疫印迹分析。用肌动蛋白归一化后的密度分析如图所示。所示数据代表三个独立的实验。数据以平均值±SD报告;星号(****)表示组间差异显著(**** p < 0.001)。b A549细胞HSP90 mRNA表达分析。细胞按上述方法处理。提取总RNA,用qPCR分析cDNA。未受刺激的细胞作为对照。平均值间差异有统计学意义(p < 0.05)。所示的数据代表三个独立的实验,每个实验都进行了三次重复。水平以任意单位表示,与假定为1的控制相比,增加了几倍。
图5
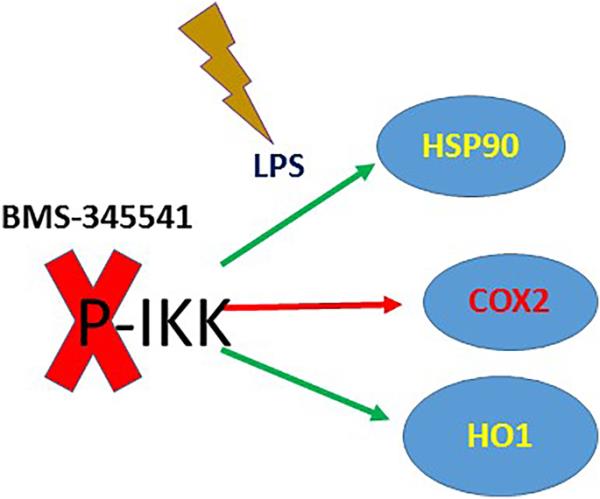
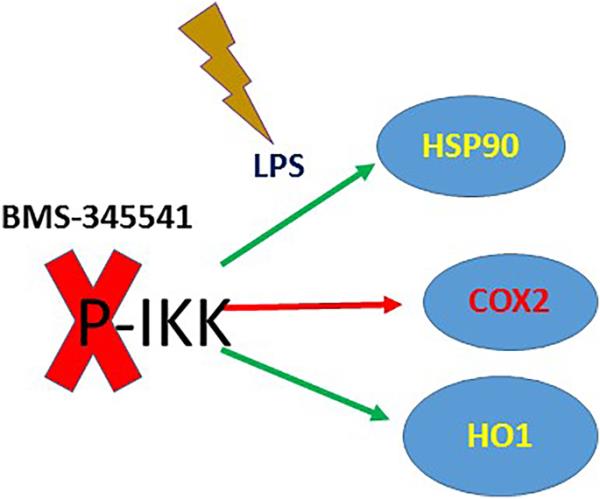
LPS处理A549中IKK激酶磷酸化缺失对抗氧化途径和HSP90活性的影响。LPS对A549细胞株IKK激酶磷酸化的改变不诱导COX2活性,但显著诱导HO1和HSP90活性。
本研究揭示了IKK激酶、Keap1与热休克和抗氧化途径之间的串扰。我们使用知名的IKK抑制剂BMS- 345,541抑制IKK激酶的磷酸化,然后分析COX2, HO1和HSP90蛋白和mRNA水平,因为它们是细胞保护网络中的关键酶。IKK激酶途径主要参与炎症信号传导和肿瘤发生:事实上,IKKα和IKKβ激酶是这些过程的基本激活剂;具体来说,IKK磷酸化与促炎细胞因子的释放和炎症介质基因mRNA水平的升高有关[23,24]。在抗癌和抗炎治疗领域广泛应用的策略是通过药物和激酶抑制剂抑制IKK复合物的长期激活。BMS- 345,541是一种合成的,众所周知的IKK激酶催化亚基抑制剂,我们在研究中使用它来抑制IKK磷酸化。我们的分析是在A549细胞系中进行的,这是一个合适的体外研究模型,因为它是一种肿瘤细胞系,因为它的Keap1等位基因点突变,而Keap1等位基因是细胞应激反应系统的重要调节因子[18]。许多研究指出Keap1、IKK激酶与HSP90之间存在串扰[11,12,24,25,26,27,28,29]。要弄清这种相互联系背后的分子机制,开发不会对细胞对氧化应激反应产生负面影响的抗炎和抗癌疗法,还有很多工作要做。BMS- 345,541在A549细胞系中积极降低lps诱导的IKK磷酸化,为进一步研究IKK抑制对两种最重要的细胞保护途径的影响提供了一个有用的体外模型。促炎活性由COX-2酶支持,COX-2酶在促炎条件发生时激活[30]。COX-2酶——也被称为前列腺素内过氧化物合成酶(PTGS)——催化形成关键的生物介质,如前列腺素(前列腺素、前列环素和血栓素)。在我们之前的研究中,我们发现Keap1蛋白提供并支持COX2活性[26],这里我们发现在A549细胞中,尽管LPS刺激,BMS- 345,541诱导的IKK活化抑制会产生COX2活性抑制。此外,我们分析了ho1活性,因为它对氧化应激的有效反应至关重要,并且代表了一种发挥关键保护作用的细胞保护酶,调节重要的生物过程,包括炎症、细胞凋亡和细胞增殖[31,32]。HO1和转录因子Nrf2之间的联系在细胞防御机制中具有重要意义。Nrf2是细胞抗氧化反应的主要调节因子。当细胞暴露于氧化应激或有害物质时,Nrf2被激活并易位到细胞核。在那里,它与靶基因启动子区域的抗氧化反应元件(AREs)的特定DNA序列结合,包括HO1。我们强调,基于抑制A549细胞中IKK的分子方法确保了HO1活性的维持。炎症反应与氧化应激的发生和热休克反应的激活密切相关。本研究结果表明BMS- 345,541是A549细胞中HSP90蛋白活性的诱导剂。这一事件表明HSP90基因和蛋白表达增加。HSP90蛋白驱动热休克反应,发挥多种功能,并与IKK激酶相互作用[27,28,33,34]。BMS- 345,541诱导的HSP90活化表明,HSP90活性不依赖于IKK磷酸化。抑制IKK磷酸化是治疗炎症进程进展的一种非常有效的方法。另外,如果考虑到hsp90作为细胞内稳态最重要的调节因子之一,在保持其活性的同时,它被证明是一个成功的结果。网络Keap1-IKK-HSP90非常有趣:它具有许多意义,涉及炎症、化疗耐药和细胞稳态[35,36,37]。
下载原文档:https://link.springer.com/content/pdf/10.1007/s10753-023-01894-3.pdf




